Saúde
- Teoria Do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas...
- Algarismos Significativos
No valor que expressa a magnitude de uma grande za através de uma unidade de medida, os algarismos conhecidos com certeza mais o algarismo duvidoso são denominados de algarismos significativos. Por exemplo, se ao medir o volume de uma amostra líquida...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- Fórmulas Moleculares, Eletrônicas E Estruturais
Fórmula química representa o número e o tipo de átomos que constituem uma molécula. Os tipos de fórmulas são: molecular, eletrônica e estrutural plana. a) Molecular: é a representação mais simples e aponta apenas quantos átomos...
- A Camada De Valência
A representação universal das camadas eletrônicas consiste no seguinte: a) São 7 camadas: K L M N O P Qb) A equação utilizada para descriminar quantos elétrons cada camada possui é:X = 2.n2 — Onde: X = número de elétronsN = número...
Saúde
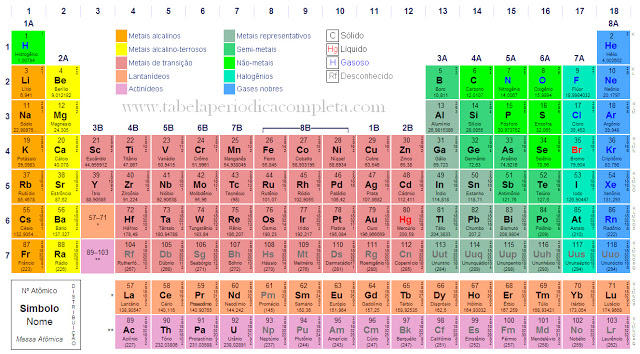
A Tabela Periódica
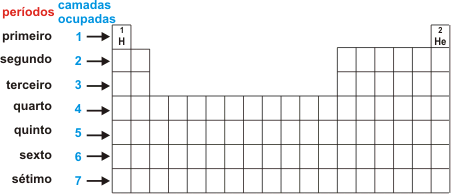
A Tabela Periódica dos Elementos Químicos atual possui filas horizontais e cada uma delas representa um período ou série. A Tabela Periódica possui sete períodos e, a depender do nível (série) em que os elementos encontram-se, é revelada a quantidade de camadas eletrônicas.
Por exemplo, os elementos Oxigênio e o Flúor estão na segunda série e possuem duas camadas eletrônicas, o Potássio e Cálcio estão no quarto período e possuem quatro níveis eletrônicos (K,L,M,N) e assim vai.

Todos os elementos da Tabela Periódica são distribuídos em sequencia numérica de acordo com seus números atômicos. Excluindo o primeiro período (onde localizam-se os elementos hidrogênio e o hélio), todos as séries começam com um metal e terminam com um gás nobre. O período mais curto possui dois elementos e o maior período possui 32 elementos.

Símbolos dos Elementos Químicos
Elemento Químico é um conjunto formado por átomos que possuem o mesmo número de prótons em seu núcleo, isto é, o mesmo número atômico (Z).
Cada elemento é reconhecido por um símbolo. O ouro, por exemplo, tem símbolo Au e o Mercúrio é o Hg. A Tabela Periódica traz uma enorme quantidade de elementos químicos. A maioria dos elementos são encontrados na natureza e são conhecidos como Elementos Naturais. Alguns elementos cujos átomos são criados artificialmente, em laboratórios, são chamados de Elementos Sintéticos. O processo de criação desses elementos é conhecido como síntese.
Todos os elementos químicos possuem número atômico, massa atômica, ponto de fusão (pf) e ponto de ebulição (pe). No total de 118 elementos, mais de 80 deles são elementos naturais e o restante são produzidos de forma artificial.
Os elementos são distribuídos na Tabela Periódica, seguindo em ordem crescente por seus números atômicos e de acordo com a semelhança de suas propriedades. O homem sempre tentou identificar os elementos químico de alguma maneira. Os alquimistas, por exemplo, representavam o ouro pelo símbolo do Sol e a prata pelo símbolo da Lua. Não importa se o elemento químico é natural ou sintético, existe sempre um símbolo atrelado a ele.
Nos dias de hoje, os símbolos seguem critérios internacionais, o que permite que um elemento químico da Tabela Periódica seja identificado em qualquer lugar do mundo, independente da língua ou alfabeto. Em outras palavras, o símbolo dos elementos químicos passou a ser universal.
O padrão adotado para a escolha da simbologia é sempre baseado no nome do elemento em latin com sua letra inicial em maiúscula, seguido, se houver necessidade, de uma segunda letra, dessa vez minúscula.
Por exemplo, o símbolo do Cálcio é Ca justamente porque já existia outro elemento com o símbolo C, no caso o Carbono.
Construção da Tabela Periódica
Os elementos são colocados em faixas horizontais (períodos) e faixas verticais (grupos ou famílias). Em um grupo, os elementos têm propriedades semelhantes e, em um período, as propriedades são diferentes.
Na tabela há sete períodos. Os grupos são numerados de 0 a 8. Com exceção dos grupos 0 e 8, cada grupo está subdividido em dois subgrupos, A e B. O grupo 8 é chamado de 8B e é constituído por três faixas verticais.
Modernamente, cada coluna é chamada de grupo. Há, portanto, 18 grupos numerados de 1 a 18.
Posição dos Elementos na Tabela Periódica
- Elementos representativos ou típicos (o último elétron é colocado em subnível s ou p): grupos A. Estão nos extremos da tabela.
- Elementos de transição (o último elétron é colocado em subnível d; apresentam subnível d incompleto): grupos 1B, 2B, 3B, 4B, 5B, 6B, 7B e 8B. Estão localizados no centro da tabela periódica.
- Elementos de transição interna (o último elétron é colocado em subnível f; apresentam subnível f incompleto). Estão divididos em duas classes:
- Lantanídeos (metais terras raras): grupo 3B e 6º período. Elementos de Z = 57 a 71.
- Actinídeos: grupo 3B e 7º período. Elementos de Z = 89 a 103.
- Gases nobres: grupo zero ou 8A ou 18.
Os grupos mais conhecidos são:1A: metais alcalinos2A: metais alcalino-terrosos6A: calcogênios7A: halogênios
Configuração eletrônica X posição do elemento na tabela
Período:
Um elemento com x camadas eletrônicas está no período x.
Exemplo: P (Z = 15) K = 2 ; L = 8 ; M = 5
P (fósforo) está no 3º período.
Grupo:
a) Elementos representativos (grupos A) e 1B e 2B. O número de elétrons na camada de valência é o número do grupo.
Exemplo: P (Z =15) → K = 2 ; L = 8 ; M = 5
O fósforo está no grupo 5A.
b) Elementos de transição: a soma do número de elétrons dos subníveis s e d mais externos é o número do grupo. Exemplo: V (Z = 23)
1s2 2s2 2p6 3s2 3p6 4s2 3d3
Soma s + d = 2 + 3 = 5 → grupo 5B.
Histórico
Em 1829, Döbereiner reuniu os elementos semelhantes em grupos de três. Cada grupo recebeu o nome de tríade. A massa atômica de um elemento era aproximadamente a média aritmética das massas atômicas dos dois outros elementos.
Exemplo: Li = 7u; Na = 23u; K = 39u
Em 1863, Chancourtois dispôs os elementos os elementos numa espiral traçada nas paredes de um cilindro, em ordem crescente de massas atômicas. Tal classificação recebeu o nome de parafuso telúrico.
Já, em 1864, Newlands dispôs os elementos em colunas verticais de sete elementos, em ordem crescente de massas atômicas, observando que de sete em set elementos havia repetição das propriedades, fato que recebeu o nome de Lei das Oitavas.
Finalmente, em 1869, Mendeleev apresentou uma classificação, que é a base da classificação periódica moderna, colocando os elementos em ordem crescente de suas massas atômicas, distribuídos em oito faixas horizontais (períodos) e doze colunas verticais (famílias). Verificou que as propriedades variavam periodicamente à medida que aumentava a massa atômica.
Fonte:
http://www.tabelaperiodicacompleta.com/
http://www.infoescola.com/quimica/tabela-periodica/
loading...
- Teoria Do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas...
- Algarismos Significativos
No valor que expressa a magnitude de uma grande za através de uma unidade de medida, os algarismos conhecidos com certeza mais o algarismo duvidoso são denominados de algarismos significativos. Por exemplo, se ao medir o volume de uma amostra líquida...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- Fórmulas Moleculares, Eletrônicas E Estruturais
Fórmula química representa o número e o tipo de átomos que constituem uma molécula. Os tipos de fórmulas são: molecular, eletrônica e estrutural plana. a) Molecular: é a representação mais simples e aponta apenas quantos átomos...
- A Camada De Valência
A representação universal das camadas eletrônicas consiste no seguinte: a) São 7 camadas: K L M N O P Qb) A equação utilizada para descriminar quantos elétrons cada camada possui é:X = 2.n2 — Onde: X = número de elétronsN = número...
