Saúde
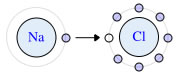
Ligação de Sódio (Na) e Cloro (Cl): o átomo de sódio doa um elétron para o átomo de Cloro.
Em uma visão mais dinâmica, este compartilhamento de elétrons ficaria assim: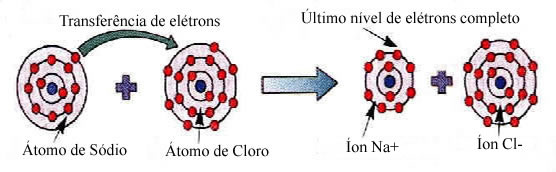
- Carga Formal
A estrutura de Lewis de uma molécula não está completa sem a atribuição das cargas formais dos átomos. As cargas formais são atribuídas considerando que as ligações químicas sejam 100% covalentes (sem caráter iônico). Exceto para moléculas...
- Teoria De Repulsão Dos Pares Eletrônicos Na Camada De Valência (rpecv)
O modelo RPECV foi introduzido por Gillespie e Nyholm na década de 1950, com o intuito de auxiliar a previsão de geometrias moleculares a partir de estruturas de Lewis. O modelo RPECV é uma ferramenta extremamente poderosa na determinação de estruturas...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- Fórmulas Moleculares, Eletrônicas E Estruturais
Fórmula química representa o número e o tipo de átomos que constituem uma molécula. Os tipos de fórmulas são: molecular, eletrônica e estrutural plana. a) Molecular: é a representação mais simples e aponta apenas quantos átomos...
- Ligações Químicas
São as ligações entre átomos. Os átomos ligam-se uns aos outros e formam as moléculas. Essas diferentes composições formam os compostos químicos É impossível se pensar em átomos como os constituintes básicos da matéria sem se...
Saúde
Teoria do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas maneiras e nas mais diversas combinações.
Os gases nobres estão isolados porque obedecem à regra do octeto, ou seja, contém oito elétrons na sua camada de valência, ou camada mais externa, mais afastada do núcleo, com exceção do Hélio, que possui dois elétrons e é estável.
Nos elementos químicos devem sempre conter 8 elétrons na última camada eletrônica ou camada de valência. Na camada K pode haver no máximo 2 elétrons. Desta forma os átomos ficam estáveis, com a configuração idêntica à dos gases nobres.
Observe a distribuição eletrônica dos gases nobres na tabela a seguir:
ELEMENTO | Z | SÍMBOLO | K | L | M | N | O | P | Q |
HÉLIO | 2 | He | 2 | - | - | - | - | - | - |
NÊONIO | 10 | Ne | 2 | 8 | - | - | - | - | - |
ARGÔNIO | 18 | Ar | 2 | 8 | 8 | - | - | - | - |
CRIPTÔNIO | 36 | Kr | 2 | 8 | 18 | 8 | - | - | - |
XENÔNIO | 54 | Xe | 2 | 8 | 18 | 18 | 8 | - | - |
RADÔNIO | 86 | Rn | 2 | 8 | 18 | 32 | 18 | 8 | - |
A estabilidade dos gases nobres deve-se ao fato de que possuem a última camada completa, ou seja, com o número máximo de elétrons que essa camada pode conter, enquanto última.
Os átomos dos demais elementos químicos, para ficarem estabilizados, devem adquirir, através das ligações químicas, eletrosferas iguais às dos gases nobres.

Os átomos menores em número de elétrons tendem a alcançar o dueto, ou seja, procuram conseguir dois elétrons na camada de valência como o hélio: (Z = 2), logo 1s2. É o caso do hidrogênio e do lítio.
Por ser a última camada, quando dois átomos se encontram a camada de valência de um toca a camada de valência do outro. A observação dos átomos já conhecidos, permite estabelecer algumas regras para a ligação eletrônica:
1º quando um átomo tiver 8 elétrons na camada de valência, existira uma “estabilidade” e ele não se ligará a outros átomos. Por isso não se pode formar nenhum composto químico com os gases nobres hélio (He); neônio (Ne); argônio (Ar); criptônio (Kr); xenônio (Xe); e randônio (Rn).
2º Quando um átomo possuir menos de 8 elétrons na camada de valência, ele tende a “associar-se” a outros átomos para completar ou eliminar a camada incompleta.
3º Com 1, 2 ou 3 elétrons na última camada, o átomo procura eliminar.
4º Com 5, 6, 7 elétrons na camada de valência, a tendência é completar.
5º Com 4 elétrons na última camada, tanto faz eliminar ou completar, dependerá do elemento químico em questão.Existe, então, uma regra prática para verificar a distribuição eletrônica de um átomo. No entanto, é importante saber que essa regra tem muitas exceções.
Levando-se em conta a representação universal das camadas (K L M N O P Q), distribui-se os elétrons do elemento químico, levando-se em conta a quantidade máxima de elétrons em cada camada, até chegar à camada de valência do elemento em questão.
Na tentativa de atingir a estabilidade sugerida pela Regra do Octeto, cada elemento precisa ganhar ou perder (compartilhar) elétrons nas ligações químicas, como no exemplo a seguir:

Ligação de Sódio (Na) e Cloro (Cl): o átomo de sódio doa um elétron para o átomo de Cloro.
Em uma visão mais dinâmica, este compartilhamento de elétrons ficaria assim:

Vamos observar o seguinte:
- O átomo de Sódio doa um elétron para o átomo de Cloro;
- Forma-se o íon Na+ com oito elétrons na camada de valência (última camada da eletrosfera);
- O íon de cloro aparece com uma carga negativa (Cl-), indicando que recebeu um elétron e atingiu a estabilidade.
Fonte:
- http://www.brasilescola.com/quimica/teoria-octeto.htm
- http://www.soq.com.br/conteudos/em/ligacoesquimicas/
- http://www.mundovestibular.com.br/articles/507/1/LIGACOES-QUIMICAS/Paacutegina1.html
loading...
- Carga Formal
A estrutura de Lewis de uma molécula não está completa sem a atribuição das cargas formais dos átomos. As cargas formais são atribuídas considerando que as ligações químicas sejam 100% covalentes (sem caráter iônico). Exceto para moléculas...
- Teoria De Repulsão Dos Pares Eletrônicos Na Camada De Valência (rpecv)
O modelo RPECV foi introduzido por Gillespie e Nyholm na década de 1950, com o intuito de auxiliar a previsão de geometrias moleculares a partir de estruturas de Lewis. O modelo RPECV é uma ferramenta extremamente poderosa na determinação de estruturas...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- Fórmulas Moleculares, Eletrônicas E Estruturais
Fórmula química representa o número e o tipo de átomos que constituem uma molécula. Os tipos de fórmulas são: molecular, eletrônica e estrutural plana. a) Molecular: é a representação mais simples e aponta apenas quantos átomos...
- Ligações Químicas
São as ligações entre átomos. Os átomos ligam-se uns aos outros e formam as moléculas. Essas diferentes composições formam os compostos químicos É impossível se pensar em átomos como os constituintes básicos da matéria sem se...
