Saúde
A estrutura de Lewis de uma molécula não está completa sem a atribuição das cargas formais dos átomos. As cargas formais são atribuídas considerando que as ligações químicas sejam 100% covalentes (sem caráter iônico). Exceto para moléculas diatômicas homonucleares, as cargas formais não são, de fato, cargas “reais”.
- Teoria Do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas...
- Teoria De Repulsão Dos Pares Eletrônicos Na Camada De Valência (rpecv)
O modelo RPECV foi introduzido por Gillespie e Nyholm na década de 1950, com o intuito de auxiliar a previsão de geometrias moleculares a partir de estruturas de Lewis. O modelo RPECV é uma ferramenta extremamente poderosa na determinação de estruturas...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- Ligações Químicas
São as ligações entre átomos. Os átomos ligam-se uns aos outros e formam as moléculas. Essas diferentes composições formam os compostos químicos É impossível se pensar em átomos como os constituintes básicos da matéria sem se...
- O Átomo
Há mais de 2.000 anos, o filósofo grego Demócrito disse que se um objeto fosse dividido em partes cada vez menores, o resultado seria pedaços tão pequenos que não seria possível dividí-los. Chamou esses pequenos pedaços de átomos (palavra grega...
Saúde
Carga Formal
A estrutura de Lewis de uma molécula não está completa sem a atribuição das cargas formais dos átomos. As cargas formais são atribuídas considerando que as ligações químicas sejam 100% covalentes (sem caráter iônico). Exceto para moléculas diatômicas homonucleares, as cargas formais não são, de fato, cargas “reais”.
As cargas formais são calculadas assumindo que o par de elétrons numa ligação química seja compartilhado igualmente entre os dois átomos, independentemente de suas eletronegatividades. A carga formal de um átomo pode ser calculada pela diferença entre o número de elétrons de valência do átomo e o número de elétrons que permaneceria nesse átomo caso os átomos ligados a ele fossem removidos homoliticamente (um elétron para cada átomo).
Muitos autores propõem que as cargas formais surgem da formação de ligações “dativas”. Usando o procedimento geral para o desenho de estruturas de Lewis e a expressão matemática para o cálculo das cargas formais, não há necessidade de lançar mão da idéia de ligação dativa para atribuir cargas formais.
Para diferenciar estados de oxidação de cargas formais, estas últimas são escritas dentro de círculos. Na ausência de indicação, a carga formal do átomo é zero.
A fórmula da carga formal (Cfo) é:
Cf = V – (L + ½ S)
Em que:
V = nº de elétrons de valência do átomo livre;
L = n} de elétrons presentes nos pares isolados (não ligantes) do átomo na estrutura;
S = nº de elétrons compartilhados pelo átomo na estrutura.
Muitos autores propõem que as cargas formais surgem da formação de ligações “dativas”. Usando o procedimento geral para o desenho de estruturas de Lewis e a expressão matemática para o cálculo das cargas formais, não há necessidade de lançar mão da idéia de ligação dativa para atribuir cargas formais.
Veja os exemplos da tabela a seguir:
Fórmula molecular | Estruturas de Lewis e cargas formais |
NH4+ | 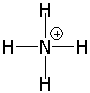 |
CN- |  |
BF4- | 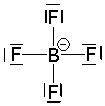 |
CO | 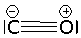 |
Para diferenciar estados de oxidação de cargas formais, estas últimas são escritas dentro de círculos. Na ausência de indicação, a carga formal do átomo é zero.
Tente você mesmo construir as estruturas mostradas na tabela acima. Depois, faça a atribuição das cargas formais usando a expressão fornecida. Perceba que o resultado líquido da soma das cargas formais é sempre igual à carga total da molécula ou do íon poliatômico.
Realizaremos o cálculo da carga formal apenas para os átomos em destaque abaixo, pois os demais estão com arranjos iguais. Assim, temos:
Perceba que só é possível calcular e atribuir as cargas formais após o desenho das estruturas de Lewis.
Resolva:
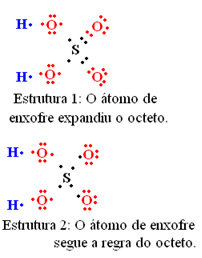
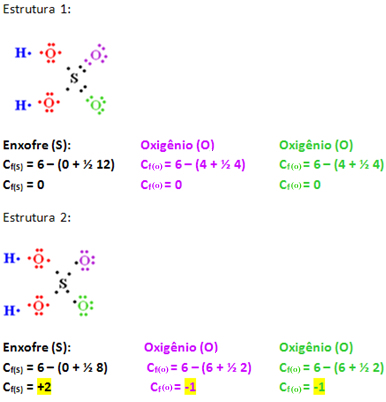
Abaixo foram propostas duas estruturas para a molécula de sulfato de hidrogênio (ácido sulfúrico, H2SO4). Realize o cálculo da carga formal e descubra qual delas tem maior probabilidade de existência real.
Resolução:
A estrutura 1 tem maior probabilidade de existência real, mesmo considerando que nessa estrutura o enxofre tenha expandido seu octeto. Isso é mostrado no cálculo da carga formal abaixo, em que os valores mais próximos de zero foram os dessa estrutura.Realizaremos o cálculo da carga formal apenas para os átomos em destaque abaixo, pois os demais estão com arranjos iguais. Assim, temos:

Fonte:
- http://200.156.70.12/sme/cursos/EQU/EQ20/modulo1/aula0/aula03/02.html
- http://exercicios.brasilescola.com/quimica/exercicios-sobre-carga-formal.htm
loading...
- Teoria Do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas...
- Teoria De Repulsão Dos Pares Eletrônicos Na Camada De Valência (rpecv)
O modelo RPECV foi introduzido por Gillespie e Nyholm na década de 1950, com o intuito de auxiliar a previsão de geometrias moleculares a partir de estruturas de Lewis. O modelo RPECV é uma ferramenta extremamente poderosa na determinação de estruturas...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- Ligações Químicas
São as ligações entre átomos. Os átomos ligam-se uns aos outros e formam as moléculas. Essas diferentes composições formam os compostos químicos É impossível se pensar em átomos como os constituintes básicos da matéria sem se...
- O Átomo
Há mais de 2.000 anos, o filósofo grego Demócrito disse que se um objeto fosse dividido em partes cada vez menores, o resultado seria pedaços tão pequenos que não seria possível dividí-los. Chamou esses pequenos pedaços de átomos (palavra grega...
