Saúde
O modelo RPECV foi introduzido por Gillespie e Nyholm na década de 1950, com o intuito de auxiliar a previsão de geometrias moleculares a partir de estruturas de Lewis. O modelo RPECV é uma ferramenta extremamente poderosa na determinação de estruturas de moléculas de elementos representativos. As estimativas de geometria providenciadas pela teoria RPECV têm sido confirmadas por dados experimentais.
De acordo com o modelo RPECV, apenas a repulsão entre pares isolados (p.i.) e pares ligados (p.l.) ao redor do átomo central são relevantes na determinação das geometrias. Pode ser estabelecida a seguinte ordem crescente de influência na determinação de geometrias:
Na molécula de amônia (NH3), a geometria é piramidal triangular (Figura 1). Se o par isolado tivesse a mesma influência que os pares ligados (as três ligações N-H), o ângulo de ligação ∠ HNH se assemelharia ao ângulo interno de um tetraedro regular: 109,5º. Entretanto, o ângulo ∠ HNH = 107º.
Desta forma os pares de elétrons se localizam o mais afastado possível, uns dos outros, para evitar uma repulsão brusca.
Fonte:
http://200.156.70.12/sme/cursos/EQU/EQ20/modulo1/aula0/aula05/01.html
http://pt.wikipedia.org/wiki/Geometria_molecular
http://www.colegioweb.com.br/quimica/teoria-da-repulsao-dos-pares-de-eletrons-da-camada-de-valencia-teoria-rpecv.html
http://en.wikipedia.org/wiki/VSEPR_theory
- Teoria Do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas...
- Carga Formal
A estrutura de Lewis de uma molécula não está completa sem a atribuição das cargas formais dos átomos. As cargas formais são atribuídas considerando que as ligações químicas sejam 100% covalentes (sem caráter iônico). Exceto para moléculas...
- Tlv - Teoria Da Ligação De Valência (química Orgânica
É uma teoria que foi desenvolvida a partir do modelo atômico quântico (onde o elétron apresenta comportamento ondulatório), para descrever a formação da ligação entre orbitais atômicos. Lembre-se: orbital (ou função de onda) é o nome...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- A Camada De Valência
A representação universal das camadas eletrônicas consiste no seguinte: a) São 7 camadas: K L M N O P Qb) A equação utilizada para descriminar quantos elétrons cada camada possui é:X = 2.n2 — Onde: X = número de elétronsN = número...
Saúde
Teoria de repulsão dos pares eletrônicos na camada de valência (RPECV)
O modelo RPECV foi introduzido por Gillespie e Nyholm na década de 1950, com o intuito de auxiliar a previsão de geometrias moleculares a partir de estruturas de Lewis. O modelo RPECV é uma ferramenta extremamente poderosa na determinação de estruturas de moléculas de elementos representativos. As estimativas de geometria providenciadas pela teoria RPECV têm sido confirmadas por dados experimentais.
De acordo com o modelo RPECV, apenas a repulsão entre pares isolados (p.i.) e pares ligados (p.l.) ao redor do átomo central são relevantes na determinação das geometrias. Pode ser estabelecida a seguinte ordem crescente de influência na determinação de geometrias:
repulsão p.l-p.l. < p.l.-p.i. < p.i.-p.i.
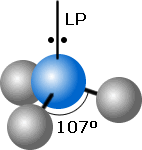 |
| Molécula da amônia. ∠ HNH = 107º (LP significa par isolado). |
Desta forma os pares de elétrons se localizam o mais afastado possível, uns dos outros, para evitar uma repulsão brusca.
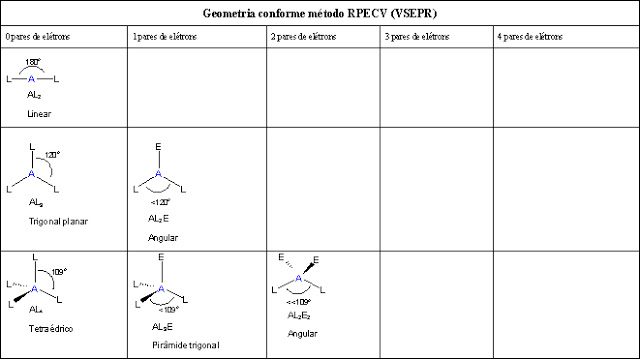
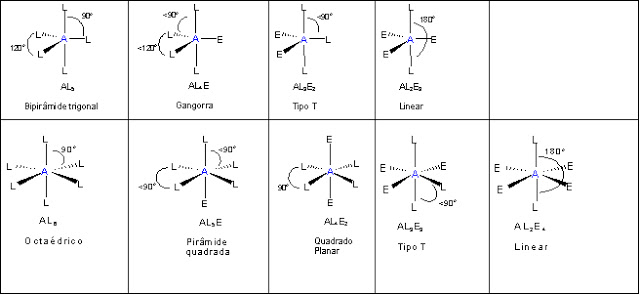
Tabela de Geometria Molecular
Observe na tabela abaixo, como estão organizados os pares de elétrons ao redor de um determinado átomo:
A = átomo centralL = átomo ou grupo ligado ao átomo centralE = pares de elétrons livres (átomo central)


Fonte:
http://200.156.70.12/sme/cursos/EQU/EQ20/modulo1/aula0/aula05/01.html
http://pt.wikipedia.org/wiki/Geometria_molecular
http://www.colegioweb.com.br/quimica/teoria-da-repulsao-dos-pares-de-eletrons-da-camada-de-valencia-teoria-rpecv.html
http://en.wikipedia.org/wiki/VSEPR_theory
loading...
- Teoria Do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas...
- Carga Formal
A estrutura de Lewis de uma molécula não está completa sem a atribuição das cargas formais dos átomos. As cargas formais são atribuídas considerando que as ligações químicas sejam 100% covalentes (sem caráter iônico). Exceto para moléculas...
- Tlv - Teoria Da Ligação De Valência (química Orgânica
É uma teoria que foi desenvolvida a partir do modelo atômico quântico (onde o elétron apresenta comportamento ondulatório), para descrever a formação da ligação entre orbitais atômicos. Lembre-se: orbital (ou função de onda) é o nome...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- A Camada De Valência
A representação universal das camadas eletrônicas consiste no seguinte: a) São 7 camadas: K L M N O P Qb) A equação utilizada para descriminar quantos elétrons cada camada possui é:X = 2.n2 — Onde: X = número de elétronsN = número...
