Saúde
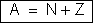
Ex.:
Resumindo: são átomos de um mesmo elemento que possuem propriedades químicas idênticas (visto apresentarem a mesma distribuição eletrônica), mas propriedades físicas diferentes.
Possuem o mesmo número atômico (Z), porém apresentam diferentes números de massa (A).
Representa-se um isótopo pelo símbolo, nº atômico (Z) e massa atômica (A) ZEA
Alguns elementos isóbaros são:
Resumindo: são átomos que têm o mesmo número de massa (A),mas diferentes números atômicos (Z). Suas propriedades químicas são totalmente diferentes.
A propriedade entre os átomos de elementos químicos diferentes que apresentam o mesmo número de nêutrons é denominada isotonia.
Isóbaros ≠ = ≠
Isótonos ≠ ≠ =
- De Que é Feito O Universo? Matéria Escura
Adriana Oliveira Bernardes [email protected] Telescópio Planck: composição da matéria escura Em artigo anterior, em que abordamos o tema constituição do universo, verificamos que a maior parte da massa do universo não é constituída...
- Teoria Do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas...
- A Tabela Periódica
A Tabela Periódica dos Elementos Químicos atual possui filas horizontais e cada uma delas representa um período ou série. A Tabela Periódica possui sete períodos e, a depender do nível (série) em que os elementos encontram-se, é revelada a quantidade...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- Fórmulas Moleculares, Eletrônicas E Estruturais
Fórmula química representa o número e o tipo de átomos que constituem uma molécula. Os tipos de fórmulas são: molecular, eletrônica e estrutural plana. a) Molecular: é a representação mais simples e aponta apenas quantos átomos...
Saúde
Isótopos, Isóbaros e Isótonos
Número atômico e número de massa
Chama-se o número atômico de um elemento o número de prótons no seu núcleo. Para um âtomo neutro, este é também o número de elétrons que o átomo possui. O número atômico geralmente é representado pela letra Z.
Chama-se o número de massa de um elemento a soma do número de prótons com o número de neutrons, isto é, o número de partículas que constituem o núcleo. Representa-se geralmente pela letra A. Assim, sendo N o número de neutrons de um núcleo, é evidente que:
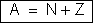
Isótopo
São variantes de um elemento químico particular. Enquanto todos os isótopos de um dado elemento compartilham o mesmo número de prótons, cada isótopo difere dos outros em seu número de nêutrons.
O termo isótopo é formado a partir das raízes gregas isos (ἴσος "igual") e Topos ("lugar" τόπος). Assim: "o mesmo lugar", significando que diferentes isótopos de um único elemento ocupam a mesma posição na tabela periódica. O número de prótons dentro núcleo do átomo identifica unicamente um elemento, mas um determinado elemento pode, em princípio, ter qualquer número de nêutrons.
O número de núcleos (soma de prótons e nêutrons) no núcleo é o número de massa (ou massa atômica), e cada isótopo de um determinado elemento tem um número de massa diferente. A diferença nos pesos atómicos resulta de diferenças no número de nêutrons nos núcleos atómicos, ou seja, os isótopos são átomos que possuem a mesma quantidade de prótons, mas não a mesma de neutrons.
Ex.:
- Isótopos de Hidrogênio: o Prótio (1 próton sem nêutron) o Deutério (1 próton e 1 nêutron) e o Trítio (1 próton e 2 nêutrons).
- Isótopos de Carbono: carbono-12, carbono-13 e carbono-14 são três isótopos do elemento carbono com os números de massa 12, 13 e 14, respectivamente. O número atômico do carbono é 6 (= número de prótons no núcleo), o que significa que cada átomo de carbono tem 6 prótons, de modo que os números de nêutrons destes isótopos são 6, 7 e 8, respectivamente.
- Isótopos do oxigênio: Oxigênio-16; Oxigênio-17; Oxigênio-18
- Isótopos do urânio: Urânio-235; Urânio-238
- Isótopos do cloro: Cloro-35; Cloro-37
Na nomenclatura científica, os isótopos são designados pelo nome do elemento seguido por um hífen e pelo número de núcleons (prótons e nêutrons) no núcleo atômico (ex: ferro-57, urânio-238,hélio-3). Na forma simbólica, o número de núcleons é escrito como um prefixo subido do símbolo químico (ex: 57Fe, 238U, ³He). Existem 339 isótopos naturais na Terra. E mais de 3100 são conhecidos.
Resumindo: são átomos de um mesmo elemento que possuem propriedades químicas idênticas (visto apresentarem a mesma distribuição eletrônica), mas propriedades físicas diferentes.
Possuem o mesmo número atômico (Z), porém apresentam diferentes números de massa (A).
Representa-se um isótopo pelo símbolo, nº atômico (Z) e massa atômica (A) ZEA
Isóbaros
São átomos de diferentes elementos químicos e, portanto, de diferentes números atômicos, que apresentam o mesmo número de massa
Alguns elementos isóbaros são:
- 6C14 (A=14 e Z=6) e 7N14 (A=14 e Z=7)
- 18Ar40 (A=40 e Z=18) e 20Ca40 (A=40 e Z=20)
Resumindo: são átomos que têm o mesmo número de massa (A),mas diferentes números atômicos (Z). Suas propriedades químicas são totalmente diferentes.
A propriedade de dois ou mais elementos apresentarem o mesmo número de massa é denominada "isobaria".
Observa-se que mesmo os isóbaros apresentando o mesmo número de massa, isso não significa que apresentem exatamente a mesma massa atômica.
Isótonos
Em química, isótonos são átomos que diferem no número atômico (número de prótons) e no número de massa, porém apresentam o mesmo número de nêutrons.
Exemplo: O Boro e o Carbono apresentam, cada um, 6 nêutrons:
- Boro: Z=5 e A=11 contém 5 prótons e 6 neutrons
- Carbono: Z=6 e A=12 contém 6 prótons e 6 neutrons
A propriedade entre os átomos de elementos químicos diferentes que apresentam o mesmo número de nêutrons é denominada isotonia.
Resumo dos Isótopos, Isóbaros e Isótonos
Prótons Massa NêutronsIsótopos = ≠ ≠
Isóbaros ≠ = ≠
Isótonos ≠ ≠ =
- IsótoPos = mesmo núimero de Prótons (P);
- IsótoNos = mesmo número de Nêutrons (N);
- IsóbAros = mesmo número de massa (A).
Fonte:
- http://www.deboni.he.com.br/ccount/click.php?id=40
- http://efisica.if.usp.br/moderna/materia/nucleos/
- http://www.qieducacao.com/2011/02/isotopos-isobaros-e-isotonos.html
- http://pt.wikipedia.org/wiki/Is%C3%B3topo
- http://pt.wikipedia.org/wiki/Is%C3%B3tono
- http://pt.wikipedia.org/wiki/Is%C3%B3baro
loading...
- De Que é Feito O Universo? Matéria Escura
Adriana Oliveira Bernardes [email protected] Telescópio Planck: composição da matéria escura Em artigo anterior, em que abordamos o tema constituição do universo, verificamos que a maior parte da massa do universo não é constituída...
- Teoria Do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas...
- A Tabela Periódica
A Tabela Periódica dos Elementos Químicos atual possui filas horizontais e cada uma delas representa um período ou série. A Tabela Periódica possui sete períodos e, a depender do nível (série) em que os elementos encontram-se, é revelada a quantidade...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- Fórmulas Moleculares, Eletrônicas E Estruturais
Fórmula química representa o número e o tipo de átomos que constituem uma molécula. Os tipos de fórmulas são: molecular, eletrônica e estrutural plana. a) Molecular: é a representação mais simples e aponta apenas quantos átomos...
