Saúde
É uma teoria que foi desenvolvida a partir do modelo atômico quântico (onde o elétron apresenta comportamento ondulatório), para descrever a formação da ligação entre orbitais atômicos.
Pela teoria da ligação de valência, uma ligação se forma através da sobreposição de orbitais semipreenchidos, ou seja, orbitais que apresentem elétrons desemparelhados.
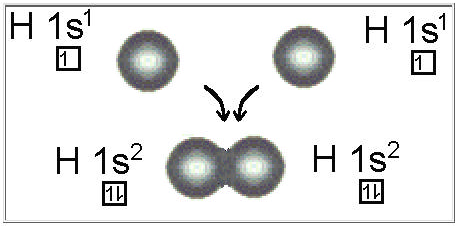 Os elétrons estão desta forma, emparelhados nos orbitais que superpuseram e são atraídos por ambos os núcleos. Desta forma há um aumento da densidade eletrônica entre os núcleos, unindo os átomos e consequentemente diminuindo a energia total do sistema, formando uma molécula estável.. Isso por ser descrito pelas funções de onda de cada um dos átomos.
Os elétrons estão desta forma, emparelhados nos orbitais que superpuseram e são atraídos por ambos os núcleos. Desta forma há um aumento da densidade eletrônica entre os núcleos, unindo os átomos e consequentemente diminuindo a energia total do sistema, formando uma molécula estável.. Isso por ser descrito pelas funções de onda de cada um dos átomos.
Segundo a TLV, os dois elétrons que participam da ligação são de spin opostos. Se os dois elétrons tiverem spins paralelos não ocorre a ligação e desta forma ocorreria repulsão, como é possível verificar abaixo:
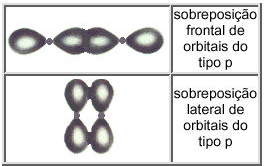
Frontal: exatamente no eixo da ligação química (direção internuclear), sendo chamada de ligação sigma (σ). Estes orbitais são cilindricamente simétricos em relação ao eixo internuclear.
- Teoria Do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas...
- Carga Formal
A estrutura de Lewis de uma molécula não está completa sem a atribuição das cargas formais dos átomos. As cargas formais são atribuídas considerando que as ligações químicas sejam 100% covalentes (sem caráter iônico). Exceto para moléculas...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- Ligações Químicas
São as ligações entre átomos. Os átomos ligam-se uns aos outros e formam as moléculas. Essas diferentes composições formam os compostos químicos É impossível se pensar em átomos como os constituintes básicos da matéria sem se...
- A Camada De Valência
A representação universal das camadas eletrônicas consiste no seguinte: a) São 7 camadas: K L M N O P Qb) A equação utilizada para descriminar quantos elétrons cada camada possui é:X = 2.n2 — Onde: X = número de elétronsN = número...
Saúde
TLV - Teoria da Ligação de Valência (Química Orgânica
É uma teoria que foi desenvolvida a partir do modelo atômico quântico (onde o elétron apresenta comportamento ondulatório), para descrever a formação da ligação entre orbitais atômicos.
Lembre-se: orbital (ou função de onda) é o nome dado a solução ou resolução de uma determinada expressão matemática (denominada também de equação de onda) que indica a provável região do espaço em volta do núcleo atômico, onde o elétron tem maior probabilidade de ser encontrado.
Pela teoria da ligação de valência, uma ligação se forma através da sobreposição de orbitais semipreenchidos, ou seja, orbitais que apresentem elétrons desemparelhados.

A força da ligação é proporcional à superposição dos orbitais atômicos. Em conseqüência os átomos na molécula tendem a ocupar uma posição em que haja um máximo de superposição entre os orbitais.
Exemplo: a molécula do hidrogênio (H2). Superposição de dois orbitais 1s.
 |
| Molécula de Hidrogênio |
 |
| Molécula de H2 após a superposição de orbitais |
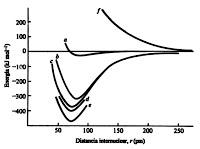 |
| Representação esquemática das curvas teóricas de energia (de a até d) para uma molécula de hidrogênio. A curva e é a curva obtida experimentalmente e a curva f demonstra a interação repulsiva de dois elétrons de spins iguais. |
A TLV prevê a existência de dois tipos de superposições de orbitais:
Lateral: quando a ligação decorre da interação lateral de orbitais; a superposição ocorre no plano da ligação química, sendo chamada de ligação pi (π)
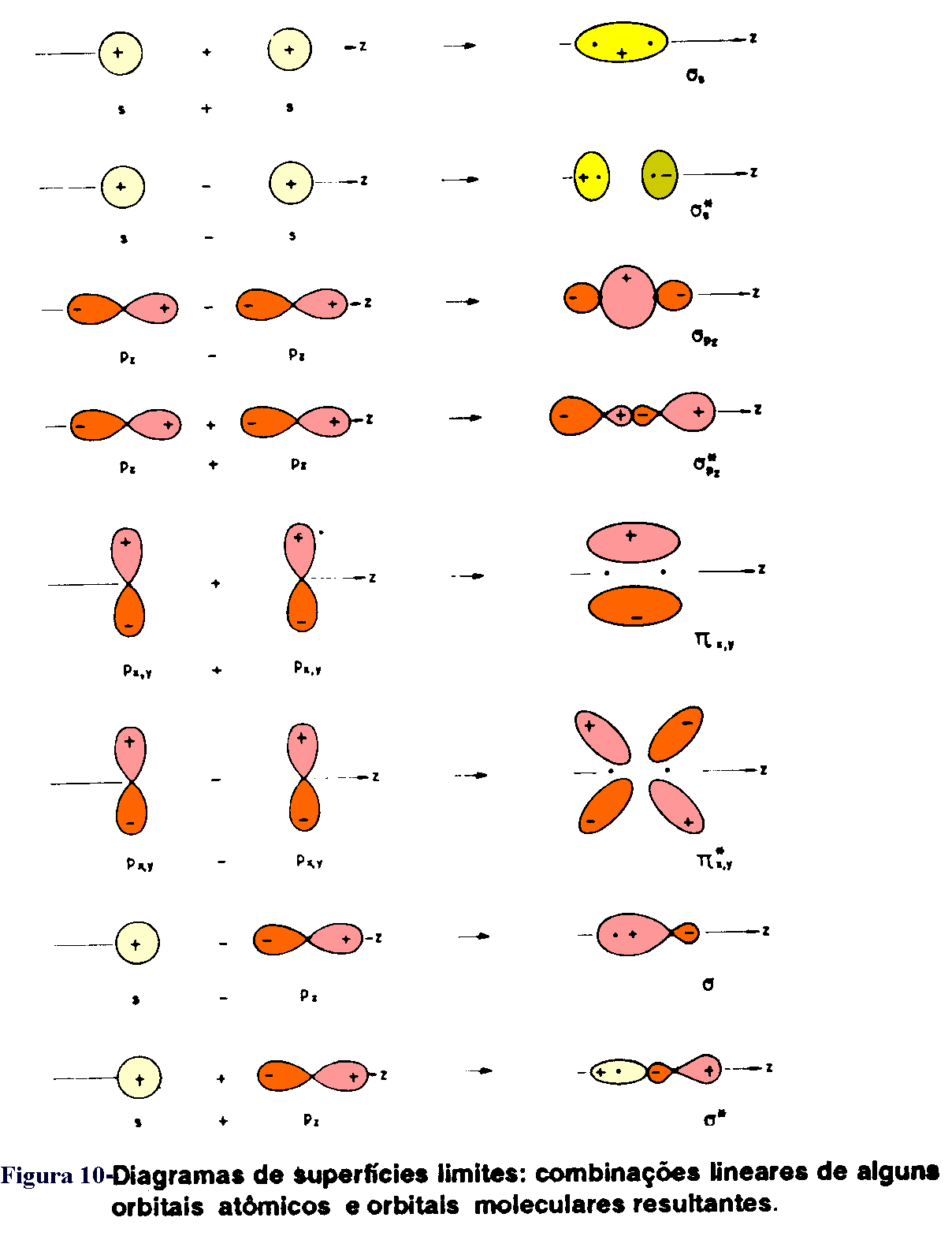
A teoria de ligação de valência utiliza a definição de orbitais atômicos híbridos para explicar tanto o compartilhamento de elétrons durante a superposição de orbitais atômicos quanto a geometria espacial apresentada pela substância formada.

Obs:
Ligação pi (π) : é a ligação formada pela aproximação lateral de orbitais (segundo eixos paralelos). A ligação pi é mais fraca e mais fácil de ser rompida; Só ocorre entre orbitais atômicos do tipo "p". As ligações pi nunca acontecem sozinhas sem que os átomos também sejam unidos por uma ligação sigma.
 |
Representação esquemática das possibilidades de superposições sigma (σ) de orbitais. |
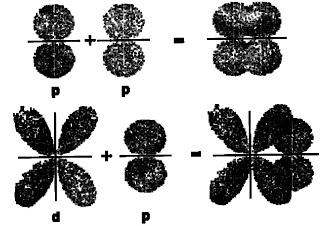 |
| Representação esquemática das possibilidades de superposições pi (π) de orbitais. |
A teoria de ligação de valência utiliza a definição de orbitais atômicos híbridos para explicar tanto o compartilhamento de elétrons durante a superposição de orbitais atômicos quanto a geometria espacial apresentada pela substância formada.

Fonte:
http://relealquimica.blogspot.com/2010/03/teoria-da-ligacao-de-valencia-tlv.html
http://www.ebah.com.br/content/ABAAAAxJwAA/teoria-orbital-atomico
http://www.ebah.com.br/content/ABAAAANU8AE/hibridizacao
loading...
- Teoria Do Octeto
A Teoria do Octeto é baseada na estabilidade dos gases nobres. De todos os elementos que existem na natureza, apenas os gases nobres podem ser encontrados livres, na forma de átomo isolado. Os demais se encontram ligados uns aos outros, de diversas...
- Carga Formal
A estrutura de Lewis de uma molécula não está completa sem a atribuição das cargas formais dos átomos. As cargas formais são atribuídas considerando que as ligações químicas sejam 100% covalentes (sem caráter iônico). Exceto para moléculas...
- Número De Oxidação - Nox
Número de oxidação (nox) é um número associado à carga de um elemento numa molécula ou num íon. O nox de um elemento sob forma de um íon monoatômico é igual à carga desse íon, portanto é igual à eletrovalência do elemento nesse íon.O...
- Ligações Químicas
São as ligações entre átomos. Os átomos ligam-se uns aos outros e formam as moléculas. Essas diferentes composições formam os compostos químicos É impossível se pensar em átomos como os constituintes básicos da matéria sem se...
- A Camada De Valência
A representação universal das camadas eletrônicas consiste no seguinte: a) São 7 camadas: K L M N O P Qb) A equação utilizada para descriminar quantos elétrons cada camada possui é:X = 2.n2 — Onde: X = número de elétronsN = número...
