Saúde
O termo análise titrimétrica refere-se à análise química quantitativa feita pela determinação do volume de uma solução cuja concentração é conhecida com exatidão, necessário para reagir quantitativamente com um volume determinado da solução que contém a substância a ser analisada.
Apesar de serem técnicas relativamente antigas, elas representam ainda economia e confiabilidade nos laboratórios mais modestos, podendo perfeitamente ser utilizadas na identificação da grande maioria de agentes químicos em diversas situações.
Será necessária na titrimetria a padronização das soluções envolvidas, pois estaremos tratando com concentrações as mais exatas possíveis. A solução cuja concentração é conhecida com exatidão é chamada de solução padrão ou solução padronizada.
A titrimetria está didaticamente dividida em quatro ramos, classificados de acordo com a reação química principal envolvida na determinação: Titrimetria ácido-base (Neutralização ou acidimetria e alcalimetria): O pH (potencial hidrogênio (H)) representa a quantidade de íons hidrogênio (H+) presentes em uma solução. É um importante condicionador de reações químicas, sendo de extrema importância sua precisa determinação e controle.
Quando a reação entre a substância a titular e a solução padronizada estiver praticamente completa, o indicador deve provocar uma mudança visual evidente (mudança de cor ou a formação de turbidez) no líquido que está sendo titulado. O ponto em que isso ocorre é chamado de ponto final da titulação.
Ao padronizar uma solução, você estará determinando sua concentração real (ou pelo menos um valor muito próximo do real). Chamemos este valor de fator de correção. O fator de correção não corrige só o erro de titulação, mas também as que oxidam.
- Indicadores Ácido-base
A titulação de um ácido por uma base e vice-versa ocorre com variação de pH e o ponto de equivalência é alcançado em um pH específico. No entanto, esta variação de pH ocorre sem nenhuma mudança física perceptível. Assim, torna-se necessário...
- Solução-padrão
Na análise titrimétrica são usadas soluções padronizadas em que a unidade básica da quantidade é o mol. Apresentam o teor elevado de pureza que permite pesar 1 mol e solubilizar com água e completar até o volume desejado.M= moles de soluto(g)/volume...
- Precisão E Exatidão
Refere-se a todo procedimento em que se mede o volume de um reagente, que é usado para reagir com um analito. Em alguns casos estes termos possuem o mesmo significado, mas no trabalho de análise química são diferentes e precisam estar acompanhados...
- Análise Gravimétrica E Precipitação
É um método analítico quantitativo cujo processo envolve a separação e pesagem de um elemento (ou um composto) na forma mais pura possível, eliminando todas as sustâncias que interferem e convertendo o constituinte ou componente desejado em um...
- Potencial Hidrogeniônico (ph) E Potencial Hidroxiliônico (poh)
O valor da concentração dos íons H+ de uma solução constitui um critério para a determinação da acidez, basicidade ou neutralidade do meio. Para obtermos essa classificação, comparamos a solução com água pura. A...
Saúde
Análise Titrimétrica
O termo análise titrimétrica refere-se à análise química quantitativa feita pela determinação do volume de uma solução cuja concentração é conhecida com exatidão, necessário para reagir quantitativamente com um volume determinado da solução que contém a substância a ser analisada.
Apesar de serem técnicas relativamente antigas, elas representam ainda economia e confiabilidade nos laboratórios mais modestos, podendo perfeitamente ser utilizadas na identificação da grande maioria de agentes químicos em diversas situações.
Será necessária na titrimetria a padronização das soluções envolvidas, pois estaremos tratando com concentrações as mais exatas possíveis. A solução cuja concentração é conhecida com exatidão é chamada de solução padrão ou solução padronizada.
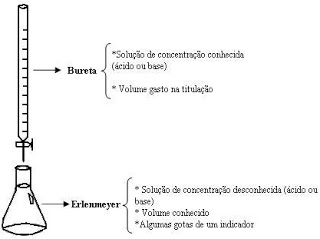
Titulante: solução com concentração conhecida (na bureta)
Titulado: substância que está sendo dosada (no Erlenmeyer)
A titrimetria está didaticamente dividida em quatro ramos, classificados de acordo com a reação química principal envolvida na determinação: Titrimetria ácido-base (Neutralização ou acidimetria e alcalimetria): O pH (potencial hidrogênio (H)) representa a quantidade de íons hidrogênio (H+) presentes em uma solução. É um importante condicionador de reações químicas, sendo de extrema importância sua precisa determinação e controle.
- Titrimetria de Óxido-Redução: este método envolve o uso de agentes oxidantes para a titulação de agentes redutores (e vice-versa). Tendo como restrição básica a necessidade de grande diferença entre os potenciais de oxidação e redução, de modo a terem-se mais nítidos resultados, sendo estes detectados por meio de indicadores químicos ou de vários métodos eletrométricos (indicadores físicos). Nesta classe incluem-se todas as reações que envolvem mudança do número de oxidação, isto é, transferência de elétrons entre os reagentes. As soluções padrões podem ser agentes oxidantes ou redutores. (Há variação de NOX)
- Titrimetria de Precipitação: O agente titulante forma um produto insolúvel com o analito. Apesar de ser efetuada com técnicas semelhantes às da Gravimetria, não está limitada pela necessidade de uma massa final mensurável, podendo lançar mão de outros parâmetros para a quantificação de resultados.
- Titrimetria de Complexação (Formação de Complexos): Objetiva a formação de um complexo (solúvel em água) com o analito, um íon metálico, este reagente muitas vezes é um agente quelante, as reações envolvidas podem ser controladas pelo pH. Usa-se o EDTA (ácido etilenodiaminotetracético), principalmente sob a forma do sal dissódico. É um dos reagentes mais importantes da análise titrimétrica.
Requisitos para se utilizar a analise titrimétrica
- Reações simples, expressa em uma única equação. A substância a ser determinada deve reagir completamente com o reagente em proporções estequiométricas ou equivalentes;
- Reações rápidas;
- No ponto de equivalência devem ocorrer modificações físicas;
- Tem que ter um indicador (reagente químico) capaz de definir claramente pela mudança de uma propriedade física (cor ou formação de precipitado) o ponto final da reação. Caso a mudança não seja visual, ainda é possível detectar o ponto de equivalência por outros meios.
Ponto Estequiométrico
Ao fim da titulação, o volume exato em que isso ocorre é chamado ponto de equivalência ou ponto final teórico ou estequiométrico. O término da titulação é detectado por meio de alguma modificação física produzida pela própria solução padronizada (mudança de cor) ou mais comumente, pela adição de um reagente auxiliar conhecido como indicador (ex: fenolftaleína).Quando a reação entre a substância a titular e a solução padronizada estiver praticamente completa, o indicador deve provocar uma mudança visual evidente (mudança de cor ou a formação de turbidez) no líquido que está sendo titulado. O ponto em que isso ocorre é chamado de ponto final da titulação.
Erro de Titulação
O ponto de equivalência e o ponto final não coincidem necessariamente. A diferença entre eles é chamada erro da titulação, o qual pode ser determinado experimentalmente. Quanto menor for a diferença entre ele maior será a precisão.Ao padronizar uma solução, você estará determinando sua concentração real (ou pelo menos um valor muito próximo do real). Chamemos este valor de fator de correção. O fator de correção não corrige só o erro de titulação, mas também as que oxidam.
Reagir estequiometricamente não é formar solução.Antes da padronização, a sua solução estava rotulada com a concentração que você desejava prepará-la, que chamaremos de Normalidade Teórica. A concentração real da solução (Normalidade Real) é definida pelo produto:
NR = fc x NT
Onde: fc = NR / NTNR = Normalidade real / fc = fator de correção / NT = Normalidade Teórica
loading...
- Indicadores Ácido-base
A titulação de um ácido por uma base e vice-versa ocorre com variação de pH e o ponto de equivalência é alcançado em um pH específico. No entanto, esta variação de pH ocorre sem nenhuma mudança física perceptível. Assim, torna-se necessário...
- Solução-padrão
Na análise titrimétrica são usadas soluções padronizadas em que a unidade básica da quantidade é o mol. Apresentam o teor elevado de pureza que permite pesar 1 mol e solubilizar com água e completar até o volume desejado.M= moles de soluto(g)/volume...
- Precisão E Exatidão
Refere-se a todo procedimento em que se mede o volume de um reagente, que é usado para reagir com um analito. Em alguns casos estes termos possuem o mesmo significado, mas no trabalho de análise química são diferentes e precisam estar acompanhados...
- Análise Gravimétrica E Precipitação
É um método analítico quantitativo cujo processo envolve a separação e pesagem de um elemento (ou um composto) na forma mais pura possível, eliminando todas as sustâncias que interferem e convertendo o constituinte ou componente desejado em um...
- Potencial Hidrogeniônico (ph) E Potencial Hidroxiliônico (poh)
O valor da concentração dos íons H+ de uma solução constitui um critério para a determinação da acidez, basicidade ou neutralidade do meio. Para obtermos essa classificação, comparamos a solução com água pura. A...
