Saúde
O ponto final é uma propriedade do indicador. O ponto estequiométrico é uma propriedade da reação química que ocorre durante a titulação. Ocorre uma modificação físico-visual antes do ponto estequiométrico visual. Quanto menor for a diferença do volume entre eles, maior será a precisão. É importante selecionar um indicador com um ponto final próximo do ponto estequiométrico da titulação de interesse.
No entanto, a teoria iônica dos indicadores não oferece explicações sobre o mecanismo pelo qual as cores são produzidas ou deixam de existir.
- Tabelas De Cores Das "borrachinhas"
Quem não quis usar o aparelho autoligado porque ama trocar as cores das ligaduras (borrachinhas), aqui estão as tabelas de cores, segundo alguns fabricantes: Essa tabela acima relaciona as cores oferecidas pela Dental Orthomundi. Cores básicas:...
- Solução-padrão
Na análise titrimétrica são usadas soluções padronizadas em que a unidade básica da quantidade é o mol. Apresentam o teor elevado de pureza que permite pesar 1 mol e solubilizar com água e completar até o volume desejado.M= moles de soluto(g)/volume...
- Prática De Doseamento De As
Titulação Ácido-BaseÉ um processo onde faz-se reagir um ácido com uma base para que se atinja o ponto de equivalência. À medida que é adicionado o titulante ao titulado, o pH da solução (titulante+titulado) vai variar, sendo possível construir...
- Potencial Hidrogeniônico (ph) E Potencial Hidroxiliônico (poh)
O valor da concentração dos íons H+ de uma solução constitui um critério para a determinação da acidez, basicidade ou neutralidade do meio. Para obtermos essa classificação, comparamos a solução com água pura. A...
- Dedo Indicador Maior Que Dedo Anular = Maior Exposição A Testosterona Intra-útero
E não tem nada a ver com o exame de toque – segundo um novo estudo, homens com dedos indicadores mais curtos do que os dedos anulares têm um risco aumentado de câncer de próstata. Os cientistas acreditam que o câncer de próstata é ligado à...
Saúde
Indicadores Ácido-Base
A titulação de um ácido por uma base e vice-versa ocorre com variação de pH e o ponto de equivalência é alcançado em um pH específico. No entanto, esta variação de pH ocorre sem nenhuma mudança física perceptível. Assim, torna-se necessário a utilização de substâncias que sinalizem o ponto de equivalência. Estas substâncias são chamadas de indicadores. Os indicadores mudam de coloração em um pH determinado, sinalizando o ponto de equivalência da titulação.
Segundo Ostwald (1894) os indicadores utilizados nas titulações de neutralização, são ácidos ou bases orgânicas fracas, tendo as moléculas não dissociadas cor diferentes da dos íons. A coloração do indicador dependerá da espécie predominante.
Substancia que muda de cor quando passa da forma ácida para a forma básica (ácido-base) ou da forma oxidada para a forma reduzida (redox).
Segundo Ostwald (1894) os indicadores utilizados nas titulações de neutralização, são ácidos ou bases orgânicas fracas, tendo as moléculas não dissociadas cor diferentes da dos íons. A coloração do indicador dependerá da espécie predominante.
Assim, para o Indicador básico, temos os seguintes comportamentos:
- A adição de uma gota de ácido a uma solução neutra de indicador básico aumentará a presença de H+ na solução, fixando os íons OH-, provenientes da dissociação e deslocando o equilíbrio acima para a direita. Assim, na presença de ácido, a solução terá a cor determinada pela espécie Ind+.
- Se adicionarmos uma gota de base à solução de indicador básico, os íons OH- fixarão os íons Ind+ provenientes da dissociação de IndOH. Assim, o equilíbrio será deslocado para a esquerda e haverá um predomínio da espécie IndOH e a solução terá a cor determinada por esta espécie.
Os Indicadores Ácidos possuem hidrogênio ionizável na estrutura, quando o meio está ácido (pH<7), a molécula de indicador é "forçada" a manter seus hidrogênios devido ao efeito do íon comum, nesta situação a molécula está neutra. Quando o meio está básico (pH>7), os hidrogênios do indicador são fortemente atraídos pelos grupos OH- (hidroxila) para formarem água, e neste processo são liberados os ânions do indicador (que possuem coloração diferente da coloração da molécula).
Escala de pH
Existe uma escala de acidez e alcalinidade que vai de zero a quatorze. O maior número indica solução básica (alcalina) e o menor número indica uma solução ácida. Se o valor de pH for sete, ou seja, a metade, então a solução não é nem ácida e nem básica, ela é neutra. Quanto mais a solução se aproxima de zero, mais ácida ela é. Quanto mais a solução se aproxima do quatorze, mais básica ela é.
Na prática, o pH pode ser medido com indicadores ácido-base e também através de aparelhos que medem a condutividade elétrica das soluções.
Os indicadores mudam de cor em diferentes valores de pH. Para essa mudança de cor damos o nome de viragem e para o valor do pH damos o nome de ponto de viragem.
Faixa de viragem dos indicadores
A faixa de viragem dos indicadores é a região do pH onde há um predomínio de uma das espécies dissociadas de maneira a ocorrer uma mudança de coloração perceptível no meio. O olho humano só consegue perceber uma mudança de coloração quando a concentração de uma das espécies é superior em 10 vezes a concentração da outra espécie.
A tabela abaixo mostra as faixas de viragem para alguns indicadores usados normalmente em titrimetria:
| Mudanças de cor dos indicadores (Atkins & Jones, 2012 | |||
| Indicador | Cor | Zona de viragem do indicador - pH | |
| Forma ácida | Forma Básica | ||
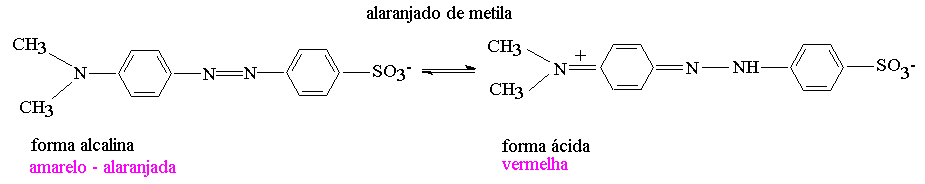
| Alaranjado de metila | Vermelho | Amarelo | 3,2 – 4,4 |
| Alizarina | Vermelho | Violeta | 11,0 – 12,4 |
| Amarelo de alizarina R | Amarelo | Vermelho | 10,1 – 12,0 |
| Azul de bromofenol | Amarelo | Azul | 3,0 – 4,6 |
| Azul de timol pK 1,7 | Vermelho | Amarelo | 1,2 – 2,8 |
| Azul de timol pK 8,9 | Vermelho | Amarelo | 8,0 – 9,6 |
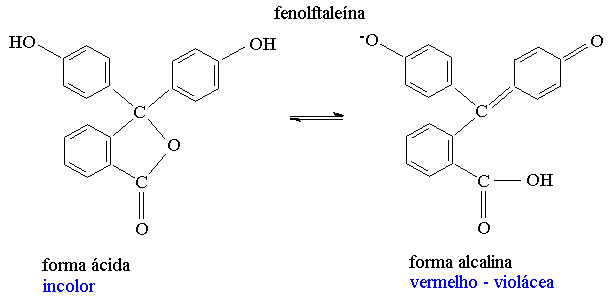
| Fenolftaleína | Incolor | rosa | 8,2 – 10,0 |
| Tornassol | Vermelho | Azul | 5,0 – 8,0 |
| Verde de bromocresol | Amarelo | Azul | 3,8 – 5,4 |
| Vermelho de fenol | Amarelo | Vermelho | 6,6 – 8,0 |
| Vermelho de metila | Vermelho | Amarelo | 4,8 – 6,0 |
O ponto final é uma propriedade do indicador. O ponto estequiométrico é uma propriedade da reação química que ocorre durante a titulação. Ocorre uma modificação físico-visual antes do ponto estequiométrico visual. Quanto menor for a diferença do volume entre eles, maior será a precisão. É importante selecionar um indicador com um ponto final próximo do ponto estequiométrico da titulação de interesse.
No entanto, a teoria iônica dos indicadores não oferece explicações sobre o mecanismo pelo qual as cores são produzidas ou deixam de existir.
Aqui a teoria cromófora oferece uma explicação única para a formação das cores: "A coloração das substâncias deve-se à presença de certos grupos de átomos ou ligações duplas nas moléculas".
Indicadores básicos, no entanto, tornar-se-ão menos sensíveis aos íons H+, assim, as zonas de transição tendem a ser deslocadas para valores mais baixos de pH (maior concentração de íons H+).
Indicadores básicos, no entanto, tornar-se-ão menos sensíveis aos íons H+, assim, as zonas de transição tendem a ser deslocadas para valores mais baixos de pH (maior concentração de íons H+).
A teoria cromófora explica a mudança de coloração dos indicadores como devida a um reagrupamento molecular determinado pela variação das condições de pH do meio, que define o surgimento ou desaparecimento dos grupos cromóforos.


Fatores que influenciam o comportamento dos indicadores
- Temperatura
- Força iônica
- Presença de solventes orgânicos
Passos da análise dos sistemas titulométricos para a escolha do indicador
Estes passos de análise teórica devem ser executados antes da análise no laboratório, visto que, a não observância da relação pH do ponto de equivalência/ pH do ponto final poderá levar a um considerável erro.
Calcular o pH:
- Antes de iniciar a titulação.
- Entre o início da adição do titulante e o ponto de equivalência.
- No ponto de equivalência.
- Entre o ponto de equivalência e o final da titulação.
Fonte
- Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente - Atkins, Peter; Jones, Loretta - 5 ª Ed. Porto Alegre: Bookman, 2012
- Indicadores de pH - http://www.ufpa.br/quimicanalitica/sindicador.htm
loading...
- Tabelas De Cores Das "borrachinhas"
Quem não quis usar o aparelho autoligado porque ama trocar as cores das ligaduras (borrachinhas), aqui estão as tabelas de cores, segundo alguns fabricantes: Essa tabela acima relaciona as cores oferecidas pela Dental Orthomundi. Cores básicas:...
- Solução-padrão
Na análise titrimétrica são usadas soluções padronizadas em que a unidade básica da quantidade é o mol. Apresentam o teor elevado de pureza que permite pesar 1 mol e solubilizar com água e completar até o volume desejado.M= moles de soluto(g)/volume...
- Prática De Doseamento De As
Titulação Ácido-BaseÉ um processo onde faz-se reagir um ácido com uma base para que se atinja o ponto de equivalência. À medida que é adicionado o titulante ao titulado, o pH da solução (titulante+titulado) vai variar, sendo possível construir...
- Potencial Hidrogeniônico (ph) E Potencial Hidroxiliônico (poh)
O valor da concentração dos íons H+ de uma solução constitui um critério para a determinação da acidez, basicidade ou neutralidade do meio. Para obtermos essa classificação, comparamos a solução com água pura. A...
- Dedo Indicador Maior Que Dedo Anular = Maior Exposição A Testosterona Intra-útero
E não tem nada a ver com o exame de toque – segundo um novo estudo, homens com dedos indicadores mais curtos do que os dedos anulares têm um risco aumentado de câncer de próstata. Os cientistas acreditam que o câncer de próstata é ligado à...
