Saúde

2° 21,5ml de NaOH (com 300,0 mg As – rosa claro)
3° 24ml de NaOH (com 310,0 mg As – rosa claro)
Vf = 21,5+24/2 = 22,75ml
- Indicadores Ácido-base
A titulação de um ácido por uma base e vice-versa ocorre com variação de pH e o ponto de equivalência é alcançado em um pH específico. No entanto, esta variação de pH ocorre sem nenhuma mudança física perceptível. Assim, torna-se necessário...
- Solução-padrão
Na análise titrimétrica são usadas soluções padronizadas em que a unidade básica da quantidade é o mol. Apresentam o teor elevado de pureza que permite pesar 1 mol e solubilizar com água e completar até o volume desejado.M= moles de soluto(g)/volume...
- Preparando Nacl 0,9%
O soro fisiológico é uma solução na qual o soluto é o cloreto de sódio, cuja fórmula química é NaCl , e o solvente é a água destilada. Geralmente a concentração do soro fisiológico é de 0,9% em massa o que significa que em 100 gramas de...
- Material De Laboratório
Figura 1: Vidrarias. 1) Bureta; 2) Funil de separação; 3) Balão de fundo redondo; 4) Balão de destilação; 5) Balão de fundo chato; 6) Béquer; 7) Condensador; 8) Tubo de ensaio; 9) Vidro de relógio; 10) Bastão de vidro; 11) Funil; 12) Proveta;...
- Potencial Hidrogeniônico (ph) E Potencial Hidroxiliônico (poh)
O valor da concentração dos íons H+ de uma solução constitui um critério para a determinação da acidez, basicidade ou neutralidade do meio. Para obtermos essa classificação, comparamos a solução com água pura. A...
Saúde
Prática de Doseamento de As
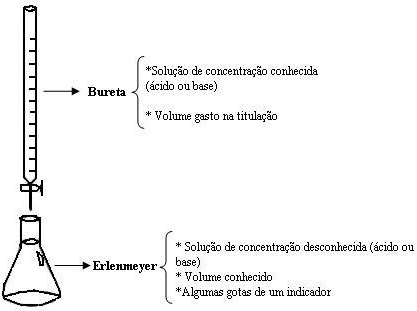
Titulação Ácido-Base
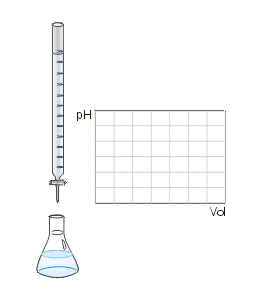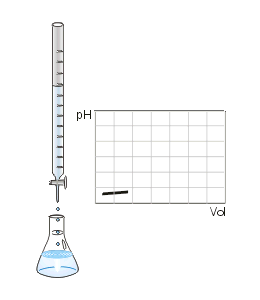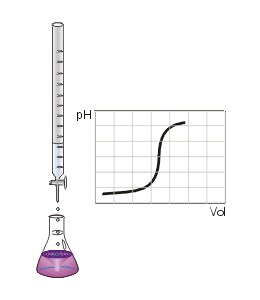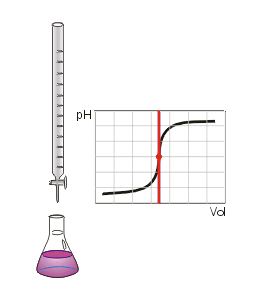
É um processo onde faz-se reagir um ácido com uma base para que se atinja o ponto de equivalência. À medida que é adicionado o titulante ao titulado, o pH da solução (titulante+titulado) vai variar, sendo possível construir um gráfico desta variação, ao qual se dá o nome de curva de titulação. O ponto de equivalência pode variar dependendo da concentração inicial do titulante e do titulado.Titulação de neutralização: quando todo H+ vai reagir estequiometricamente (neutralizar) toda a solução.
- A solução que possui a concentração desconhecida é chamada de titulado.
- A solução de concentração conhecida é denominada titulante.
Doseamento de As (PM= 138,12)
Sol NaOH 0,1M fc 0,98
Materiais e Reagentes
- Ácido Salicílico
- Hidróxido de Sódio
- Fenolftaleína
- Álcool previamente neutralizado
- Erlenmeyer
- Béqueres de 50mL
- Proveta
- Conta Gotas
- Bureta
- Anel Metálico
- Suporte Universal
- Balança analítica
- Garra
Preparo da Amostra:
- Tare a balança com o Erlenmeyer em cima;
- Pese 300,0 mg de As diretamente no Erlenmeyer (Pesagem direta);
- Solubilize o As com 15ml de álcool previamente neutralizado ( O álcool contém hodroxila e o As tem H+; Se o álcool não for neutralizado, reagirá com o As, causando menos gasto de NaOH, ocorrendo ERRO ANALÍTICO);
Adiciona-se o indicador ácido-base ( fenolftaleína), gota a gota, no Erlenmeyer sem deixar cair na lateral (3 gotas);
Doseamento:
Faça esse procedimento 2 vezes:
- Rinçar a bureta (Rinçar: solubilizar a bureta com a solução).
- Preencha a bureta com o NaOH.
- Prenda a bureta na garra, sem cobrir a graduação e atrapalhar a leitura do menisco.
- Realizar o gotejamento da solução titulante sobre a solução titulada. Segure com a mão direita o Erlenmeyer e vá colocando, aos poucos, o NaOH da bureta graduada (normalmente de 50 mL, que permite o controle da quantidade de titulante que é adicionada ao titulado); Coloque o NaOH q.s.
- Mexa a amostra delicadamente e continuamente;
- É necessária também muita atenção, pois é preciso interromper o gotejamento exatamente quando a quantidade de íons H+ e OH-, em mol, da solução titulante, ficar igual à da solução titulada.
- Utilize a técnica da meia-gota (encoste a bureta no erlenmeyer e espere a gota chegar na solução);
- Quando a solução do Erlenmeyer começar a ficar rosa claro, é o ponto de viragem.
- Aguarde + ou - 5min com o erlenmeyer em repouso. Se sumir a cor, teve o ponto de viragem.
Ponto de equivalência ou ponto de viragem: é nesse momento em que a quantidade adicionada de titulante, em mol, é igual à determinada pela proporção estequiométrica para a reação com o titulado. É possível verificar esse ponto quando ocorre a mudança de cor da solução. Por exemplo, se for usado o indicador fenolftaleína, o seu ponto de viragem ocorre quando há a mudança do incolor para o rosa, ou vice-versa.

Resultados dos experimentos:
1° 0,1ml de NaOH (sem As – branco – pula o item 5)2° 21,5ml de NaOH (com 300,0 mg As – rosa claro)
3° 24ml de NaOH (com 310,0 mg As – rosa claro)
Volume
Vf = V1+ V2/2Vf = 21,5+24/2 = 22,75ml
O volume do experimento branco não conta nessa fase.
Vreal = Vf-Vb
Vreal = 22,75– 0,1 = 22,65ml
0,1N = 0,1M
M= X.N
X= nº H+ ionizáveis
300 + 310/2 = 305mg
Vreal = Vf-Vb
Vreal = 22,75– 0,1 = 22,65ml
0,1N = 0,1M
M= X.N
X= nº H+ ionizáveis
Massa
Mf = M1+M2/2 = Xmg300 + 310/2 = 305mg
1ml N NaOH ___________________ 138,12mg As
22,65ml x 0,1N x 0,98_____________ Xmg
X= 306,58mg (correção da concentração)
Grau de pureza:
m/M x 100%
306,58/305 x 100 = 100,52%
loading...
- Indicadores Ácido-base
A titulação de um ácido por uma base e vice-versa ocorre com variação de pH e o ponto de equivalência é alcançado em um pH específico. No entanto, esta variação de pH ocorre sem nenhuma mudança física perceptível. Assim, torna-se necessário...
- Solução-padrão
Na análise titrimétrica são usadas soluções padronizadas em que a unidade básica da quantidade é o mol. Apresentam o teor elevado de pureza que permite pesar 1 mol e solubilizar com água e completar até o volume desejado.M= moles de soluto(g)/volume...
- Preparando Nacl 0,9%
O soro fisiológico é uma solução na qual o soluto é o cloreto de sódio, cuja fórmula química é NaCl , e o solvente é a água destilada. Geralmente a concentração do soro fisiológico é de 0,9% em massa o que significa que em 100 gramas de...
- Material De Laboratório
Figura 1: Vidrarias. 1) Bureta; 2) Funil de separação; 3) Balão de fundo redondo; 4) Balão de destilação; 5) Balão de fundo chato; 6) Béquer; 7) Condensador; 8) Tubo de ensaio; 9) Vidro de relógio; 10) Bastão de vidro; 11) Funil; 12) Proveta;...
- Potencial Hidrogeniônico (ph) E Potencial Hidroxiliônico (poh)
O valor da concentração dos íons H+ de uma solução constitui um critério para a determinação da acidez, basicidade ou neutralidade do meio. Para obtermos essa classificação, comparamos a solução com água pura. A...
