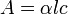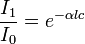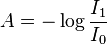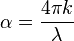Saúde
- Solução-padrão
Na análise titrimétrica são usadas soluções padronizadas em que a unidade básica da quantidade é o mol. Apresentam o teor elevado de pureza que permite pesar 1 mol e solubilizar com água e completar até o volume desejado.M= moles de soluto(g)/volume...
- Análise Titrimétrica
O termo análise titrimétrica refere-se à análise química quantitativa feita pela determinação do volume de uma solução cuja concentração é conhecida com exatidão, necessário para reagir quantitativamente com um volume determinado da solução...
- Preparando Nacl 0,9%
O soro fisiológico é uma solução na qual o soluto é o cloreto de sódio, cuja fórmula química é NaCl , e o solvente é a água destilada. Geralmente a concentração do soro fisiológico é de 0,9% em massa o que significa que em 100 gramas de...
- Natureza Da Cor E Absorção De Luz
O conhecimento da absorção de luz pela matéria é a forma mais usual de determinar a concentração de compostos presentes em solução. A maioria dos métodos utilizados em bioquímica clínica envolve a determinação espectrofotométrica de compostos...
- Potencial Hidrogeniônico (ph) E Potencial Hidroxiliônico (poh)
O valor da concentração dos íons H+ de uma solução constitui um critério para a determinação da acidez, basicidade ou neutralidade do meio. Para obtermos essa classificação, comparamos a solução com água pura. A...
Saúde
Lei de Beer-Lambert-Bouguer
Quando um feixe de luz monocromática, atravessava um meio transparente homogêneo, cada camada deste meio absorvia igual a fração de luz que atravessava, independentemente da intensidade da luz que incidia. A partir desta conclusão foi enunciada a seguinte lei:
" A intensidade da luz emitida decresce exponencialmente à medida que a espessura do meio absorvente aumenta aritmeticamente ".
Esta lei foi descoberta pela primeira vez em 1729 pelo matemático, geofísico e astrônomo francês Pierre Bouguer (1698-1758). A sua autoria é, contudo, freqüentemente atribuída de forma errada ao matemático, físico e astrônomo francês Johann Lambert (1728-1777). No seu trabalho em 1760, Lambert citou a descoberta de Bouguer e constatou que a fração de luz que é absorvida por uma amostra é independente da potência radiante incidente (Pλo). Este fato é conhecido como Lei de Lambert, embora, na realidade, só seja verdadeira se Pλo for pequeno e se a extensão de outros fenômenos como a dispersão da luz ou reações fotoquímicas for desprezável.
Só 92 anos depois é que a lei foi modificada de forma a incluir a concentração da solução na fórmula de cálculo. Essa modificação foi da autoria do físico e matemático alemão August Beer (1825-1863). Beer em 1852 observou a relação existente entre a transmissão e a concentração do meio onde passa o feixe de luz. Uma certa solução absorve a luz proporcionalmente à concentração molecular do soluto que nela encontra, isto é, " A intensidade de um feixe de luz monocromático decresce exponencialmente à medida que a concentração da substância absorvente aumenta aritmeticamente ".
A lei de Beer-Lambert, também conhecida como lei de Beer ou lei de Beer-Lambert-Bouguer é uma relação empírica que, na Óptica, relaciona a absorção de luz com as propriedades do material atravessado por esta. Isto se pode expressar de distintas maneiras:
- A é a absorbância (ou absorvância)
- I0 é a intensidade da luz incidente
- I1 é a intensidade da luz uma vez tendo atravessado o meio
- l é a distância que a luz atravessa pelo corpo
- c é a concentração de sustância absorvente no meio
- α é o coeficiente de absorção ou a absortividade molar da substância
- λ é o comprimento de onda do feixe de luz
- k é o coeficiente de extinção
 |
| Esquema da diminuição da potência radiante de uma radiação monocromática após atravessar uma cuvette de largura l contendo a solução com uma concentração c no componente em estudo e uma coeficiente de absorção molar característica ε. |
Em resumo, a lei explica que há uma relação exponencial entre a transmissão de luz através de uma substância e a concentração da substância, assim como também entre a transmissão e a longitude do corpo que a luz atravessa. Se conhecemos l e α, a concentração da substância pode ser deduzida a partir da quantidade de luz transmitida.
As unidades de c e α dependem do modo em que se expresse a concentração da sustância absorvente. Se a sustância é líquida, se deve expressar como uma fração molar. As unidades de α são o inverso do comprimento (por exemplo cm−1). No caso dos gases, c pode ser expressada como densidade (a longitude ao cubo, por exemplo cm−3), em cujo caso α é uma seção representativa da absorção e tem as unidades em comprimento ao quadrado (cm2, por exemplo). Se a concentração de c está expressa em moles por volume, α é a absorvância molar normalmente dada em mol cm−2. No entanto, também pode-se tratar de uma suspensão e aí a unidade de concentração é expressa em FTU.
O valor do coeficiente de absorção α varia segundo os materiais absorventes e com o comprimento de onda para cada material em particular. Deve ser determinado experimentalmente.
A lei tende a não ser válida para concentrações muito elevadas, especialmente se o material dispersa muito a luz.
A relação da lei entre concentração e absorção de luz é a base do uso de espectroscopia para determinar a concentração de substâncias em química analítica.
Para a correta utilização e aplicação da lei de Lambert-Beer, é necessário que estejam reunidos alguns pré-requisitos, nomeadamente:
- As partículas (átomos, moléculas ou iões) presentes em solução devem absorver a luz de forma independente entre si;
- O meio absorvente deve ser homogêneo (solução) e não dispersar a radiação;
- A radiação incidente deve estar colimada (raios paralelos entre si) e deve atravessar a mesma distância durante a qual interage com as partículas existentes em solução;
- A radiação deve ser monocromática, isto é, ser composta por apenas um comprimento de onda selecionado (normalmente, correspondente ao comprimento de onda para o qual a absorvância da espécie em estudo é máxima);
- O fluxo da radiação incidente não pode induzir processos que impliquem a desestabilização dos átomos, moléculas ou iões, como por exemplo excitação eletrônica que dê origem a fenômenos de fluorescência ou fosforescência.
Resolva as questões:
- Qual a concentração de MnO 4 -1 em mol L-1 de uma solução com absorbância de 0,345 à 500nm utilizando uma cubeta de 1cm? A absortividade molar a 500nm é 10.000 mol-1 Lcm-1.
- Se a absorbância de uma solução padrão de CuSO4 com concentração de 0,00025 mol L-1 foi 0,150 à 540 nm utilizando-se uma cubeta de 2 cm, qual a absortividade molar da substância neste comprimento de onda?
Fonte:
- http://www.ufrgs.br/leo/site_espec/conceito.html
- http://pt.wikipedia.org/wiki/Lei_de_Beer-Lambert
- http://wikiciencias.casadasciencias.org/index.php/Lei_de_Lambert%E2%80%93Beer
loading...
- Solução-padrão
Na análise titrimétrica são usadas soluções padronizadas em que a unidade básica da quantidade é o mol. Apresentam o teor elevado de pureza que permite pesar 1 mol e solubilizar com água e completar até o volume desejado.M= moles de soluto(g)/volume...
- Análise Titrimétrica
O termo análise titrimétrica refere-se à análise química quantitativa feita pela determinação do volume de uma solução cuja concentração é conhecida com exatidão, necessário para reagir quantitativamente com um volume determinado da solução...
- Preparando Nacl 0,9%
O soro fisiológico é uma solução na qual o soluto é o cloreto de sódio, cuja fórmula química é NaCl , e o solvente é a água destilada. Geralmente a concentração do soro fisiológico é de 0,9% em massa o que significa que em 100 gramas de...
- Natureza Da Cor E Absorção De Luz
O conhecimento da absorção de luz pela matéria é a forma mais usual de determinar a concentração de compostos presentes em solução. A maioria dos métodos utilizados em bioquímica clínica envolve a determinação espectrofotométrica de compostos...
- Potencial Hidrogeniônico (ph) E Potencial Hidroxiliônico (poh)
O valor da concentração dos íons H+ de uma solução constitui um critério para a determinação da acidez, basicidade ou neutralidade do meio. Para obtermos essa classificação, comparamos a solução com água pura. A...