Saúde
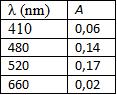
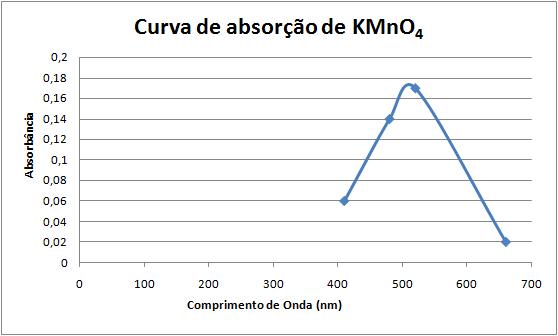
Figura 1.8 Representação da escolha do melhor comprimento de onda através da curva de KMnO4.
- Solução-padrão
Na análise titrimétrica são usadas soluções padronizadas em que a unidade básica da quantidade é o mol. Apresentam o teor elevado de pureza que permite pesar 1 mol e solubilizar com água e completar até o volume desejado.M= moles de soluto(g)/volume...
- Lei De Beer-lambert-bouguer
Quando um feixe de luz monocromática, atravessava um meio transparente homogêneo, cada camada deste meio absorvia igual a fração de luz que atravessava, independentemente da intensidade da luz que incidia. A partir desta conclusão foi enunciada a...
- Potencial Hidrogeniônico (ph) E Potencial Hidroxiliônico (poh)
O valor da concentração dos íons H+ de uma solução constitui um critério para a determinação da acidez, basicidade ou neutralidade do meio. Para obtermos essa classificação, comparamos a solução com água pura. A...
- Tlv - Teoria Da Ligação De Valência (química Orgânica
É uma teoria que foi desenvolvida a partir do modelo atômico quântico (onde o elétron apresenta comportamento ondulatório), para descrever a formação da ligação entre orbitais atômicos. Lembre-se: orbital (ou função de onda) é o nome...
- Dedo Indicador Maior Que Dedo Anular = Maior Exposição A Testosterona Intra-útero
E não tem nada a ver com o exame de toque – segundo um novo estudo, homens com dedos indicadores mais curtos do que os dedos anulares têm um risco aumentado de câncer de próstata. Os cientistas acreditam que o câncer de próstata é ligado à...
Saúde
Espectrofotômetro
Alguns componentes são comuns a todos os espectrofotômetros, como é verificado a seguir. A luz, habitualmente fornecida por uma lâmpada, é fracionada pelo prisma ou rede de difração (monocromador) nos comprimentos de onda que a compõem (luzes monocromáticas). O comprimento de onda selecionado é dirigido para a solução contida em um recipiente transparente (cubeta). Parte da luz é absorvida e parte é transmitida. A redução da intensidade luminosa é medida pelo detector (célula fotelétrica) porque o sinal elétrico de saída do detector depende da intensidade da luz que incidiu sobre ele. O sinal elétrico amplificado e visualizado no galvanômetro em números, é lido como uma absorbância e é proporcional à concentração da substância absorvene existente na cubeta. A precisão dos comprimentos de onda para análise são chamados de bandas de passagem, mais comum na ordem de 10nm. O espectro da análise mais comum é de 330nm a 1100nm para a faixa visível.
Os espectrofotômetros são instrumentos de análise que permitem:
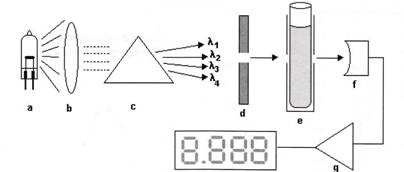
Quando uma solução de um dado composto é submetida a leituras de absorbância ao longo de uma faixa de comprimentos de onda eletromagnética, passamos a ter informações referentes à capacidade do composto em absorver luz. A representação gráfica dos valores de comprimento de onda (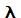 ) versus absorbância é denominada espectro de absorção.
) versus absorbância é denominada espectro de absorção.
Antes de utilizar um espectrofotômetro sempre é feita uma calibração, que é fundamental para garantir que as medições obtidas no aparelho sejam precisas. Esta calibração pode variar em vários espectrofotômetros. A maioria dos fabricantes fornece um guia sobre como calibrar o aparelho.
É muito importante ao colocar a amostra a ser analisada, não tocar no tubo de ensaio na parte do meio, para evitar manchas de dedo que alteram a leitura do aparelho. Assim, o ideal é pegar na parte superior do tubo e colocá-lo no aparelho para que ele faça a leitura e dê o resultado almejado. Além disto, para que um espectrofotômetro funcione corretamente, deve ser aquecido antes de usar. Muitos dispositivos demoram cerca de 10 minutos para aquecer.
É muito importante ao colocar a amostra a ser analisada, não tocar no tubo de ensaio na parte do meio, para evitar manchas de dedo que alteram a leitura do aparelho. Assim, o ideal é pegar na parte superior do tubo e colocá-lo no aparelho para que ele faça a leitura e dê o resultado almejado. Além disto, para que um espectrofotômetro funcione corretamente, deve ser aquecido antes de usar. Muitos dispositivos demoram cerca de 10 minutos para aquecer.
 |
| Esquema óptico dos principais componentes do espectrofotômetro. As letras representam: (a) fonte de luz, (b) colimador, (c) prisma ou rede de difração, (d) fenda seletora de X, (e) compartimento de amostras com cubeta contendo solução, (f) célula fotelétrica, (g) amplificador. |
Os espectrofotômetros são instrumentos de análise que permitem:
- Selecionar o comprimento de onda (lâmbda) da radiação adequado à análise de um determinado componente
- Medir a intensidade I do feixe emergente que corresponde a um determinado feixe incidente Io, convertendo o sinal recebido no detector em medida de Absorvância para o comprimento de onda da análise. Em outras palavras, criar o "Branco" e em seguida fazer as medidas com a amostra.
- Determinar a concentração de uma espécie em solução a partir do gráfico da variação de absorvância (ou transmitância) em função da concentração de várias soluções-padrão.
Espectro de absorção
Quando uma solução de um dado composto é submetida a leituras de absorbância ao longo de uma faixa de comprimentos de onda eletromagnética, passamos a ter informações referentes à capacidade do composto em absorver luz. A representação gráfica dos valores de comprimento de onda (
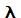 ) versus absorbância é denominada espectro de absorção.
) versus absorbância é denominada espectro de absorção. Como a interação da luz com a matéria depende da estrutura química dos compostos, o espectro de absorção é uma forma de caracterização que permite verificar qual a faixa de comprimento de onda em que um dado composto apresenta sua maior afinidade de absorção.
Embora dois ou mais compostos possam absorver luz dentro da mesma faixa de comprimento de onda, isso não invalida a especificidade do método, pois, normalmente, esta não reside no espectro de absorção. Contudo, a sensibilidade do método depende da escolha do melhor comprimento de onda eletromagnética para leituras espectrofotométricas, pois só assim poderemos detectar o composto em baixas concentrações.
Curva de absorção para Permanganato de Potássio
Os resultados das leituras espectrofotométricas de uma solução de KMnO4 (4,5 mg/%) estão resumidos na Figura 1.8. Os dados de comprimento de onda ( 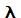 ) versus absorbância foram utilizados na elaboração da curva de absorção.
) versus absorbância foram utilizados na elaboração da curva de absorção.
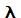 ) versus absorbância foram utilizados na elaboração da curva de absorção.
) versus absorbância foram utilizados na elaboração da curva de absorção. 

Figura 1.8 Representação da escolha do melhor comprimento de onda através da curva de KMnO4.
Para efeito comparativo, seria conveniente construir uma curva de transmissão, ou seja, um gráfico de comprimento de onda versus transmitância.
Por outro lado, o valor de melhor comprimento de onda para KMnO4 encontrado na literatura é de 520 nm, sendo recomendada a faixa de comprimento de onda de 490 a 530 nm como aceitável do ponto de vista de sensibilidade para medidas espectrofotométricas.
O melhor comprimento de onda para uma determinada solução é aquele no qual há maior absorção e, portanto, menor transmissão de luz; ou seja: maior absorbância e menor transmitância.
Curva-padrão
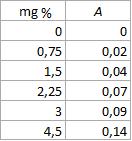
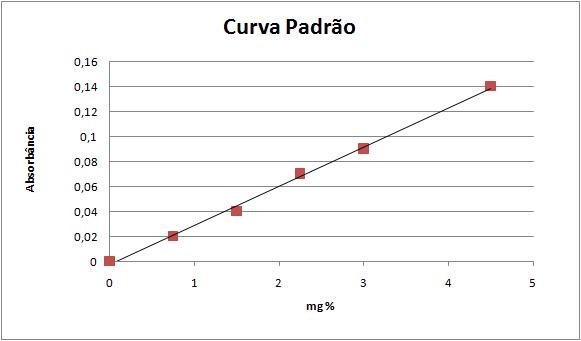
A curva-padrão corresponde à relação gráfica entre os valores de absorbância (A) e os de concentração. Com base na análise gráfica é possível verificar a linearidade da reação e calcular um fator de conversão de valores de absorbância em concentração.
Inicialmente, verificamos no espectrofotômetro a absorbância (A) das soluções cujas concentrações sejam conhecidas, por exemplo:

Com os dados obtidos foi construído o seguinte gráfico para a Curva padrão de KMnO4:

Quando quisermos saber a concentração de uma solução, acha-se a densidade ótica leva-se este dado a curva, encontrando-se imediatamente sua concentração.
Fator de Calibração :
Pode-se determinar também a concentração de uma solução pela seguinte relação:
====================
Cd = Ad X FC
====================
Onde: Cd - concentração do desconhecido
Ad - absorbância do desconhecido
FC (fator de calibração) – média dos valores de Cp/Ap
Ap - absorbância do padrão
Cp - concentração do padrão
Fonte:
- http://www.ufrgs.br/leo/site_espec/espectrodeantipiril.html
- http://www.ufrgs.br/leo/site_espec/componentes.html
- http://www.ufrgs.br/leo/site_espec/espectrodeabsorcao.html
- http://www.ufrgs.br/leo/site_espec/curvapadrao.html
- http://pt.wikipedia.org/wiki/Espectrofot%C3%B4metro
- http://www.infoescola.com/materiais-de-laboratorio/espectrofotometro/
loading...
- Solução-padrão
Na análise titrimétrica são usadas soluções padronizadas em que a unidade básica da quantidade é o mol. Apresentam o teor elevado de pureza que permite pesar 1 mol e solubilizar com água e completar até o volume desejado.M= moles de soluto(g)/volume...
- Lei De Beer-lambert-bouguer
Quando um feixe de luz monocromática, atravessava um meio transparente homogêneo, cada camada deste meio absorvia igual a fração de luz que atravessava, independentemente da intensidade da luz que incidia. A partir desta conclusão foi enunciada a...
- Potencial Hidrogeniônico (ph) E Potencial Hidroxiliônico (poh)
O valor da concentração dos íons H+ de uma solução constitui um critério para a determinação da acidez, basicidade ou neutralidade do meio. Para obtermos essa classificação, comparamos a solução com água pura. A...
- Tlv - Teoria Da Ligação De Valência (química Orgânica
É uma teoria que foi desenvolvida a partir do modelo atômico quântico (onde o elétron apresenta comportamento ondulatório), para descrever a formação da ligação entre orbitais atômicos. Lembre-se: orbital (ou função de onda) é o nome...
- Dedo Indicador Maior Que Dedo Anular = Maior Exposição A Testosterona Intra-útero
E não tem nada a ver com o exame de toque – segundo um novo estudo, homens com dedos indicadores mais curtos do que os dedos anulares têm um risco aumentado de câncer de próstata. Os cientistas acreditam que o câncer de próstata é ligado à...
